代謝型グルタミン酸受容体の膜貫通領域における活性化スイッチの同定
by Masataka Yanagawa
代謝型グルタミン酸受容体(mGluR)は、我々の脳神経系に広く発現し、記憶や学習、様々な感覚情報処理を司るGタンパク質共役型受容体(GPCR)である。また、mGluRは統合失調症をはじめとする精神疾患の治療薬の標的分子としても注目されている。
本研究では、mGluRについて200種を超える網羅的な変異体解析を行った結果、mGluRの活性制御に関わるアミノ酸残基を膜貫通領域に複数同定し、それらの中の一組の相互作用が受容体の活性・不活性状態のスイッチングに重要な役割を担っていることを突き止めた。このスイッチ領域に結合する薬剤が過去に報告されており、本研究によってそれらの薬剤が働く分子メカニズムの一端を明らかにすることができた。
研究の動機
本研究では、Gタンパク質共役型受容体(GPCR)の機能発現メカニズムの一般性・多様性の理解を目的とし、ロドプシンとは異なるGPCRファミリーに属する代謝型グルタミン酸受容体(mGluR)の変異体解析を行った。ロドプシンとmGluRの間にはアミノ酸配列の相同性がほとんどないにもかかわらず、両者は共通のGタンパク質を活性化し、細胞内シグナル伝達系を駆動することができる。多様なGPCRによる共通のGタンパク質の活性化はいかにして実現されているのだろうか。この疑問に答えるためには、mGluRの構造と機能の関わりを解明し、ロドプシンと比較する必要がある。さらに、mGluRの生理的役割の重要性もmGluRを研究する動機のひとつである。mGluRの活性化機構を解明することは、我々の脳の働きを分子レベルで理解することにつながると期待される。
背景:我々の脳の活動を制御するGPCR、代謝型グルタミン酸受容体
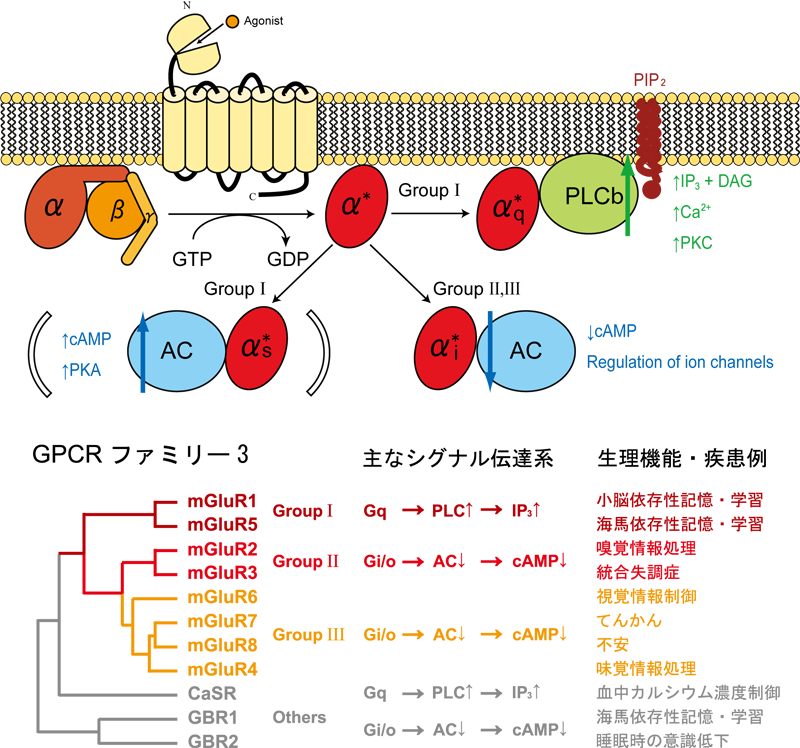
mGluRは、我々の脳神経系に広く発現し、記憶や学習・様々な感覚情報処理の分子基盤を担うほか、統合失調症やてんかん・不安などの精神疾患に対する治療薬のターゲットとしても注目される受容体である(図1)。したがって、mGluRの構造・機能連関の解析はこれらの病気への薬の作用機序を理解する上でも重要な課題であると言えるだろう。
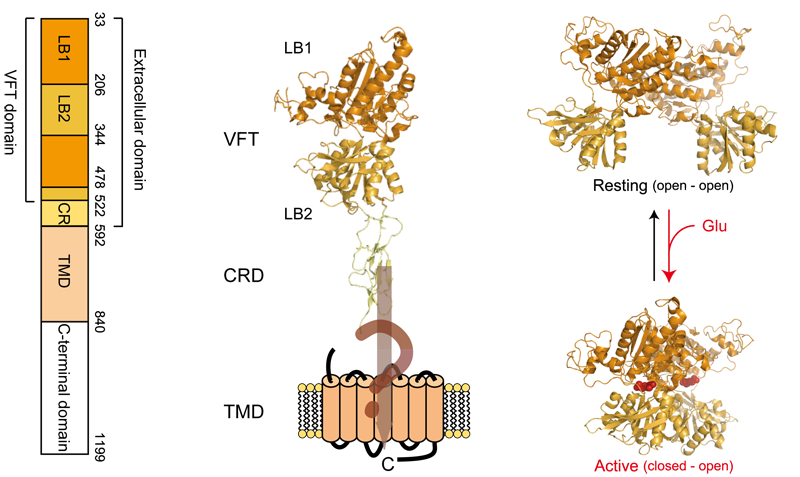
図1. 代謝型グルタミン酸受容体の分類と生理機能
細胞外に大きなリガンド結合領域を持つGPCR、代謝型グルタミン酸受容体
mGluRはGPCRが共通して持つ七回膜貫通領域に加え、細胞外に大きなリガンド結合領域を有している。細胞外領域に関してはX線結晶構造解析により、活性・不活性状態双方の詳細な構造が明らかになっている(Kunishima et al, Nature 2000)。mGluRは常にホモ二量体で機能することが知られており、リガンド結合に伴う二量体の配向変化が生じることが活性化に重要であることが示されている(図2)。
図2. 代謝型グルタミン酸受容体の細胞外リガンド結合領域
代謝型グルタミン酸受容体の膜貫通領域はどのようにして活性状態を形成するのか?
しかしながら、Gタンパク質と直接相互作用する膜貫通領域に関する構造情報はほとんどない。グルタミン酸が結合した際に生じる細胞外領域の構造変化が、いかにして膜貫通領域へと伝わりGタンパク質を活性化するのだろうか。本研究では、この疑問に答えるため、mGluRの膜貫通領域に網羅的に変異を導入、mGluRの活性化に重要なアミノ酸残基を探索した。
結果と考察
代謝型グルタミン酸受容体の膜貫通領域に複数の構成的活性変異を同定
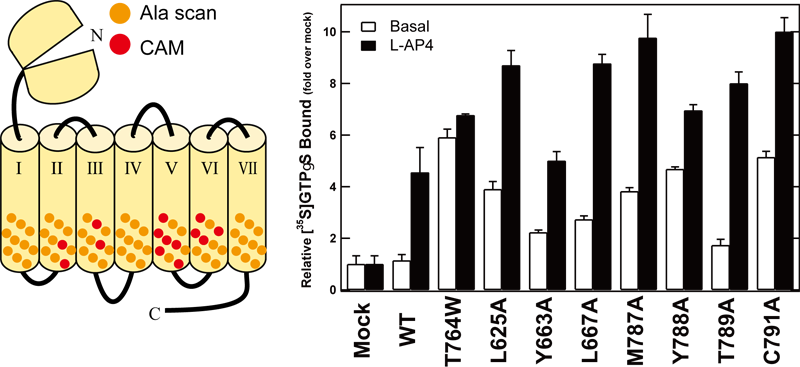
mGluR8の膜貫通領域のアミノ酸を網羅的にアラニンに置換した変異体を作製し、Gタンパク質活性化能を測定した結果、ヘリックスⅡ,Ⅲ,Ⅴ,Ⅵに複数の構成的活性変異(CAM)が同定された(図3)。構成的活性変異体では、導入された変異によって構造が活性状態を模倣し、リガンド刺激がない状態でもGタンパク質を活性化してしまう。したがって、その変異部位は受容体を不活性状態に維持しておくために重要な残基であると一般に考えられている。
図3. mGluR8の膜貫通領域における構成的活性変異
ヘリックスⅤのスレオニン残基とヘリックスⅢのチロシン残基の相互作用を同定
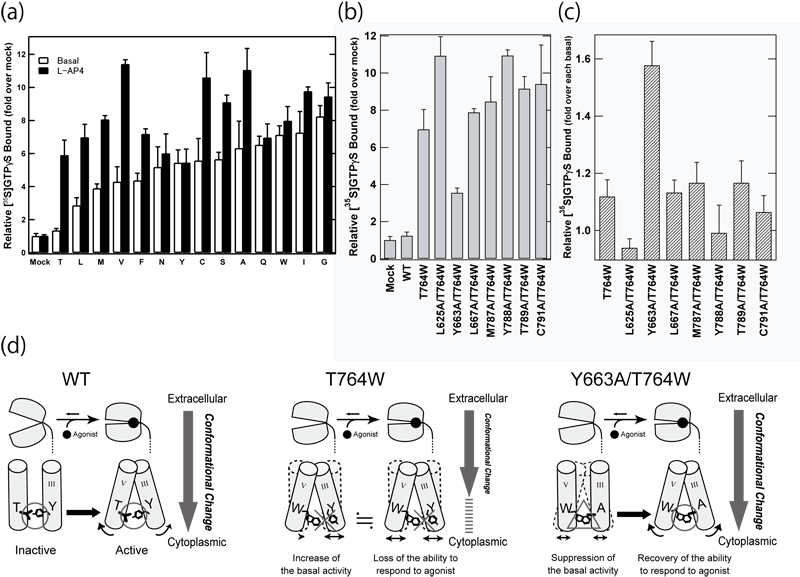
上述した構成的活性変異部位の中で、ヘリックスⅤのスレオニン(T764)残基を他のすべてのアミノ酸に置換した変異体を作製・解析した結果、T764は何に変えてもリガンド非依存的活性が上昇することが判明した(図4a)。また、このT764をトリプトファン(W)に置換すると、リガンド依存的な活性能上昇の抑制が観測された。したがって、T764は野生型において受容体の不活性化維持に不可欠な残基であり、活性化の過程でリガンド結合部位の構造変化を細胞質側へと伝達する役割を果たしている可能性が考えられた。
さらに、T764Wと他のアラニン変異体を組み合わせた網羅的な二重変異体解析を行った結果、ヘリックスⅢのチロシン残基(Y663)をアラニンに置換すると、二重変異体(Y663A/T764W)のGタンパク質活性化能が野生型に近づくことが観察され、両残基の相互作用が示唆された(図4b,c)。以上の解析により、このヘリックスⅢ-Ⅴ間の相互作用がmGluRの膜貫通領域の中央において、細胞外のリガンド結合シグナルを細胞質側へと伝達し、受容体の不活性・活性状態を切り替える分子スイッチを形成していることが示唆された(図4d)。
図4. (a) T764変異体のGタンパク質活性能 (b) T764Wと他のCAMを組み合わせた二重変異体のリガンド非依存的活性 (c) T764Wと他のCAMを組み合わせた二重変異体のリガンド依存的活性 (d) mGluRにおける活性化スイッチのモデル
mGluRに対する薬剤の作用部位としての活性化スイッチ
本研究で同定された活性化スイッチを担う残基のうち、ヘリックスⅢのチロシン残基はmGluRの活性を制御する薬剤(MPEP, EM-TBPC)の結合部位のひとつとして過去に報告されている(Malherbe et al, JBC 2003, Molecular Pharmacology 2003)。したがって、これらの薬剤は、本研究で同定された活性化スイッチを調節することにより、受容体の活性制御を行っている可能性が考えられる。特に、MPEPはパーキンソン病の治療薬としても注目されており、その作用機序が分子レベルで解明されれば、より効果的な薬の設計につながることが期待される。
論文
Activation switch in the transmembrane domain of metabotropic glutamate receptor.
Yanagawa M, Yamashita T, Shichida Y
Mol Pharmacol.2009, Jul;76(1):201-7. Epub 2009 Apr 27.