脊椎動物の非視覚機能を担うOpn5の分子特性の制御に重要なアミノ酸残基を特定
by Chihiro Fujiyabu概要
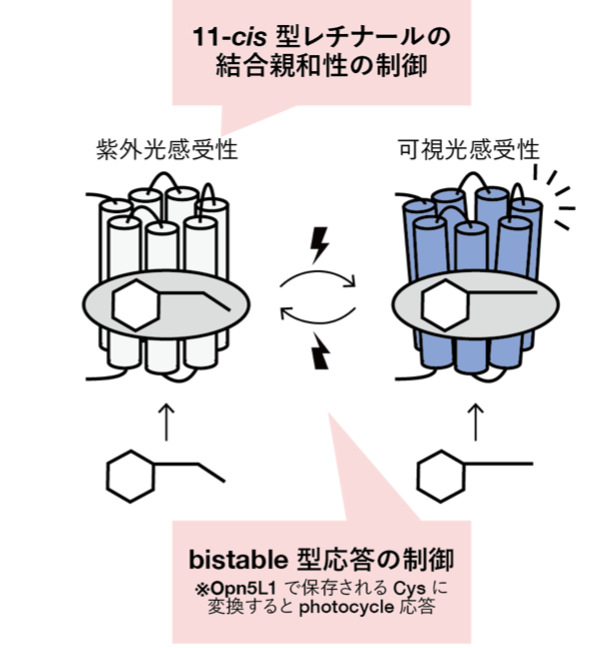
オプシンは動物の多様な光受容機能に共通して関わる光受容タンパク質です。多くのオプシンは11-cis型レチナールを共有結合し、光受容によってこれをall-trans型へと異性化することで活性化し、光情報を細胞応答へと変換します。動物が持つ多様なオプシン遺伝子は、アミノ酸配列に基づいて幾つかのグループに分けられます。本研究で着目しているOpn5は、オプシン類の中で1つの独立したグループを形成しながら、グループ内で分子特性がユニークに多様化しているオプシングループです。Opn5グループの中で、哺乳類が唯一持つOpn5mは、11-cis型レチナールを結合して紫外光感受性の光受容体として機能します。またOpn5mは11-cis型だけでなく、親和性は低いもののall-trans型レチナールを直接結合することもできます。そして、光受容によって不活性状態と活性状態を相互変換できるというbistable型の光反応特性を示します。近年、このような特徴的な分子特性を有するOpn5mが、哺乳類においていくつかの重要な非視覚機能を制御することが明らかになってきました。 そこで本研究では、Opn5グループの分子特性が多様化し、Opn5mが特徴的な分子特性を持つための分子メカニズムの解明を目指しました。その結果、Opn5mが11-cis型レチナールを結合し、紫外光を受容してbistable型の光反応特性を示すために重要なアミノ酸残基として188番目のスレオニン残基を同定しました。本研究成果は2022年1月18日にcommunications biology誌にて発表されました。
研究の背景
動物は光情報を、ものの形や色を認識する視覚機能だけではなく、時刻や季節の認識といった多様な非視覚機能に利用します。これら多様な光受容に共通して機能するのが、光受容に特化したGタンパク質共役型受容体 (GPCR) であるオプシン類です。動物は多種多様なオプシン遺伝子を持っており、それらはアミノ酸配列に基づいて幾つかのグループに分けられます。その中でも、Opn5はその中で一つの独立したグループを形成します。脊椎動物のOpn5遺伝子は多様化しており、少なくとも3つのサブグループ (Opn5m、Opn5L1、Opn5L2) に分類されます。各サブグループのOpn5は、吸収する光波長、結合するレチナール異性体の選択性、光反応特性といった分子特性がそれぞれ異なります (図1)。例えばヒトを含む脊椎動物が広く持つタイプであるOpn5mサブグループは、11-cis型レチナールを結合し、紫外光感受性の光受容体として機能します。Opn5mは11-cis型だけでなく、親和性は低いもののall-trans型レチナールを直接結合することもできます。そして、不活性状態と活性状態を光受容によって相互変換できるというbistable型の光反応特性を示します。一方で、Opn5L1サブグループは11-cis型レチナールを直接結合することができず、all-trans型レチナールのみを結合して、暗状態で直接活性状態を形成します。またこの活性状態は可視光感受性であり、可視光を受容して不活性状態へと構造変化すると、そこでレチナールの熱異性化が起こり、元の活性状態が自律的に回復するというphotocycle型の光応答特性を示します。photocycle型の光応答特性を持つオプシンはOpn5L1しか見つかっていないため、Opn5グループは分子特性がユニークに多様化しているオプシングループであると言えます。また各サブグループはそれぞれ生体内での発現部位が異なるため、関わる生理機能も多様化している可能性があります。このようなOpn5の分子特性や発現部位の多様化は、各Opn5が異なる生理機能を制御するための基盤となり、動物の多様な光受容機能を支えていると考えられます。
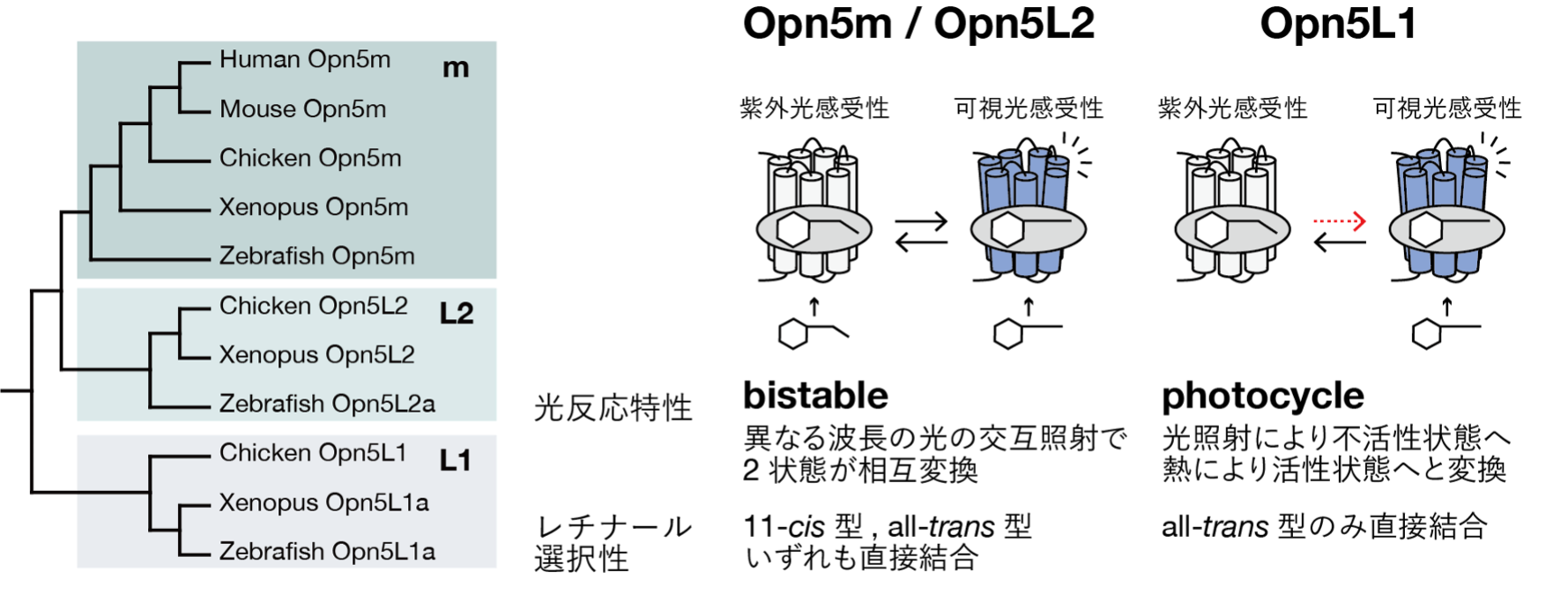
図1 Opn5の分子特性の多様性
Opn5m / Opn5L2は11-cis型レチナールだけではなく、all-trans型レチナールも直接結合することができるbistable型のオプシンである。
一方Opn5L1はall-trans型レチナールとのみ結合することができるphotocycle型のオプシンである。
研究成果
本研究ではOpn5グループのうち、ヒトも持つbistable型の紫外光受容体であるOpn5mに着目し、その分子特性の制御メカニズムの解明を目的として解析を行いました。まず他のOpn5サブグループのアミノ酸配列との比較と変異体解析を行うことで、Opn5mでよく保存されている188番目のスレオニン残基を制御に関わる残基候補として見出しました。そして、このアミノ酸残基に対する変異導入による分子特性の変化を調べることで、188番目のスレオニン残基がOpn5mの光受容機能を果たす上でどのような役割を担っているのかについて検討しました。その結果、この188番目のスレオニン残基に変異を導入すると、11-cis型レチナールの結合能が低下し、bistable型の光反応特性が損なわれることが確認されました (図2)。さらには、この残基をOpn5L1サブグループでよく保存されるシステインに置換すると、11-cis型レチナールとの結合能が失われ、all-trans型レチナールとのみ結合して直接活性状態を形成し、光受容による構造変化の後、熱的に元の活性状態へ自己再生するというphotocycle型の分子特性を示しました。この分子特性は、Opn5L1サブグループの分子特性に極めて類似しています。以上の結果から、Opn5mが11-cis型レチナールを結合し、紫外光を受容して活性化するbistable型の光受容体として機能する際に、188番目のスレオニン残基が重要な役割を果たすことがわかりました。さらにこの位置のアミノ酸残基の多様化は、Opn5グループの分子特性の多様化に関与している可能性が強く示唆され、Opn5が動物の多様な非視覚機能を支えられるよう分子進化してきた過程を解明する手がかりとなると期待されます。
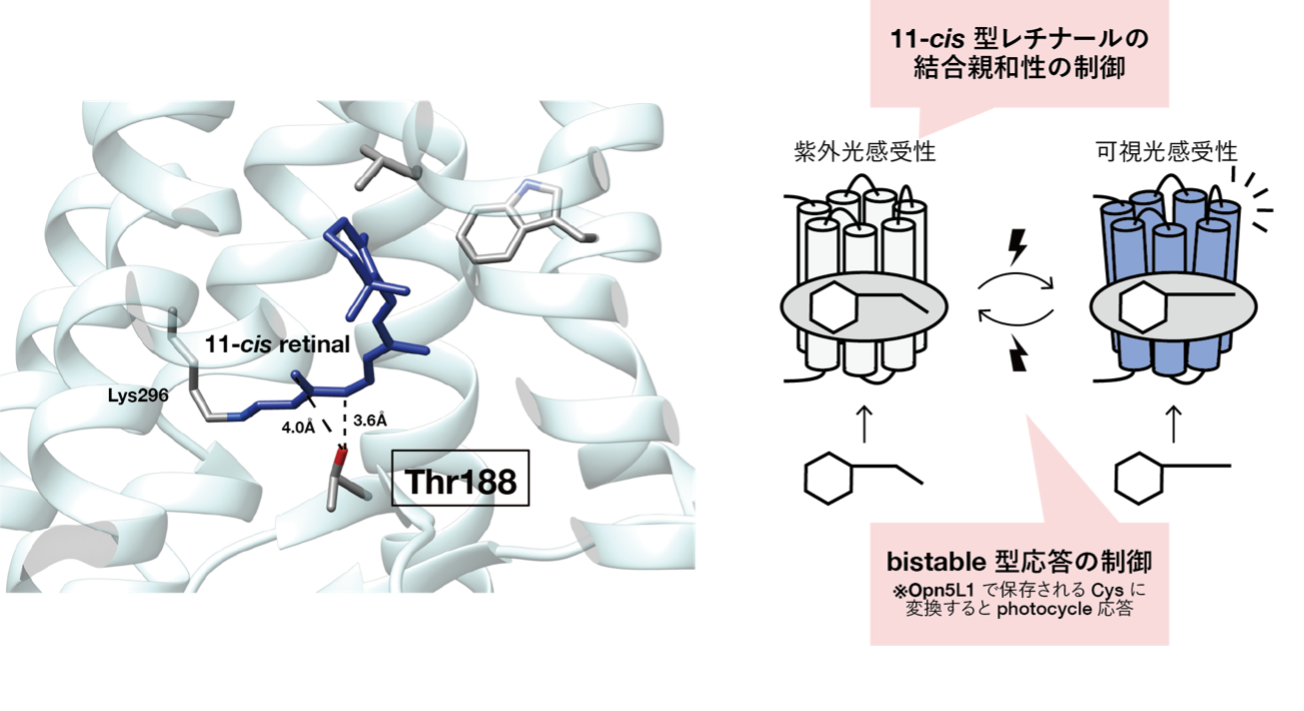
図2 Opn5mの構造モデルと188番目のスレオニン残基の役割
188番目のスレオニン残基はレチナール近傍に位置し、Opn5mの11-cis型レチナールへの結合選択性とbistable型の光反応特性の制御に関わる。
