オプシン類は拡散性のリガンドを持つ祖先型のGPCRから進化したと考えられるが、一般のGPCRとは違ってリガンド分子であるレチナールがオプシン部分と共有結合している。この共有結合を欠いたウシロドプシンの変異体を作製して解析した結果、共有結合はレチナールの光反応特性には必要がないが、活性状態の生成には重要な役割を果たすことがわかった。つまり、ロドプシンは分子進化の過程でレチナールとの共有結合をうまく利用することで効率的にG蛋白質を活性化するようになったと考えている。
ロドプシンがリガンドと共有結合している機能的・進化的な意義
by Take Matsuyama背景
ロドプシンは7回膜貫通α-ヘリックス構造や活性化のために必要なマイクロドメイン(ERYモチーフ等)など、他のGPCRと共通の構造機能ドメインを持っている。しかし光受容に特化したロドプシンは他のGPCRには見られない特徴を持っている。一般的にGPCRは拡散性のリガンドが非共有結合を介してレセプターに結合して受容体の活性を制御するのに対して、ロドプシンでは共有結合したリガンド(レチナール)が受容体の活性を制御している。
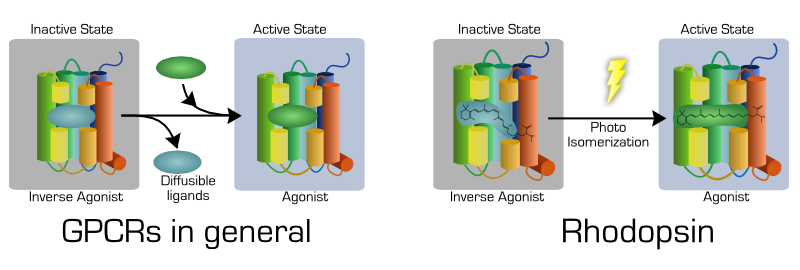
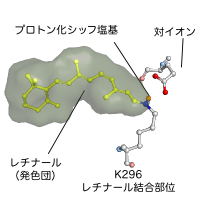
レチナールはロドプシンの296番目(ウシロドプシンのアミノ酸番号)のリシン残基にシッフ塩基を介して共有結合している。しかし全てのオプシン類がレチナールとの共有結合を持つにも関わらず、その機能的意義は明かされていない。また1991年にはロドプシンとレチナールの共有結合を無くしたK296G変異体の解析が行われたが、その結果レチナールとの共有結合がなくてもロドプシンが生成し機能すると報告された。ではロドプシンとレチナールの共有結合の機能的意義は何だろうか?我々は同じK296G変異体を用いて共有結合の機能を詳細に検討した。
ロドプシンK296G変異体
ロドプシンのK296G変異体はレチナール結合部位であるK296を持たないので通常の発色団(レチナール)を結合する事が出来ない。しかしK296G変異体はレチナールとプロピルアミンを反応させることによって生成するレチナールシッフ塩基を発色団として取り込むことが出来る。このように生成したK296Gロドプシンは野生型ロドプシンに似ているが発色団が蛋白質部分と共有結合をしていない。
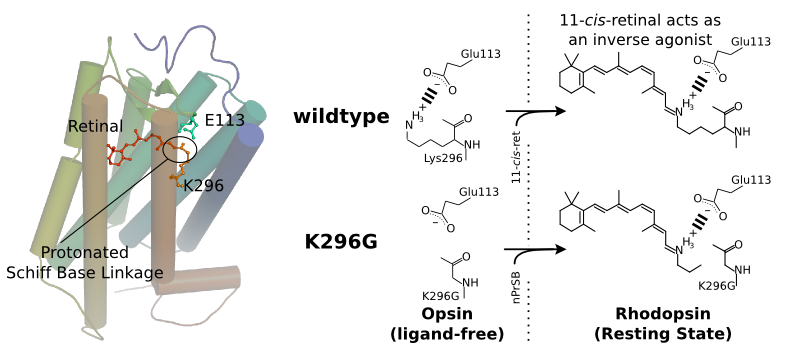
ロドプシンとレチナールの共有結合は光反応には寄与しない
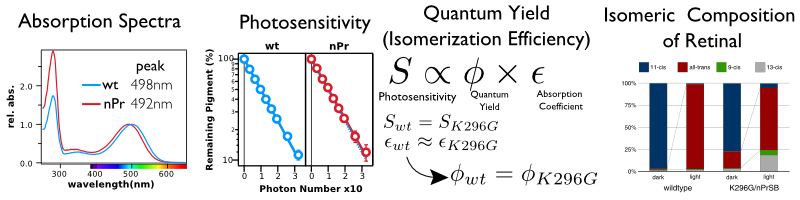
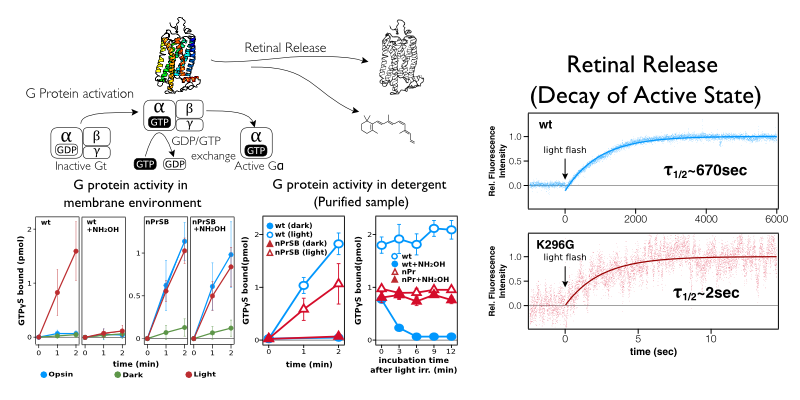
ウシロドプシンのK296G変異体を解析した結果、暗状態での分光学的な特徴や光を吸収してレチナールを異性化する効率等はロドプシンとレチナールの共有結合の有無に影響されないことが分かった。下図はK296G変異体の暗スペクトル、光感受性、レチナール組成を調べたものである。測定したデータからレチナールの量子収率を計算しても野生型とK296Gでは違いが無いことが分かった。つまりK296Gは野生型と同じように高効率でレチナールが光を吸収しレチナールを11シスからオールトランスに異性化(特異的異性化)させるのである。
ロドプシンとレチナールの共有結合は効率的な活性状態の生成に必須である
共有結合のの有無に影響されなかった光反応とは対照的に、レチナールの異性化以降に起こる熱反応は大きな影響を受けた。種々の中間体は不安定になり(論文参照)活性状態の寿命も400倍近く短くなった(下図右)。光異性化のエネルギーを活性構造の生成に必要な変化に伝えるためにはリガンドとの共有結合が必要と思われる。さらにG蛋白質の活性化測定によってK296GはG蛋白質を活性化しているが活性化しているのはレチナールが遊離しているオプシンの状態であるということが分かった。つまりK296Gは野生型のオプシンとは異なり構成的活性(constitutive activity)を示すが、光依存的な活性を示さなくなっていることがわかった。構成的活性の強さは光依存的な活性の半分程度である。つまりロドプシンでは効率的な活性状態を獲得するためにアゴニストと共有結合しているメリットを生かしていると考えられる。その結果として、共有結合がないとアゴニストがタンパク質部分から簡単に遊離してしまうことも推定された。
ロドプシンとレチナールの共有結合には次の2つの役割がある。
- 異性化のエネルギーを効率的にタンパク質部分に伝える
- 低アフィニティーリガンドを無理矢理レセプターに結合させておく
